当社では大学や研究機関で樹立された遺伝子改変マウスのライセンス許諾を受けて販売しています。
製品
ラインアップ
| モデルマウス名 | バックグラウンド系統 | 価格(税別) | ||
|---|---|---|---|---|
| 凍結胚(50個) | オスメス2ペア | 繁殖許諾権価格 | ||
| 生体ストレス可視化マウス (UMAI-Lucマウス) |
C57BL/6N(黒毛) | 10万円 | 34万円 | アカデミア価格 : 20万円 (購入施設における交配・繁殖制限なし) 営利企業向け価格 : 20万円 (購入施設における交配・繁殖制限有(年間15匹)まで、 制限を超えた匹数については追加費用) |
| C57BL/6N(albino)(白毛) | 15万円 | 52万円 | ||
| Tg型小胞体ストレス可視化マウス (ERAI-Lucマウス) |
C57BL/6N(黒毛) | 10万円 | 34万円 | |
| C57BL/6N(albino)(白毛) | 15万円 | 52万円 | ||
| KI型小胞体ストレス可視化マウス (ERAI-Lucマウス) |
C57BL/6N(黒毛) | 10万円 | 34万円 | |
| C57BL/6N(albino)(白毛) | 15万円 | 52万円 | ||
| 酸化ストレス可視化マウス (OKD-Lucマウス) |
C57BL/6N(黒毛) | 10万円 | 34万円 | |
| C57BL/6N(albino)(白毛) | 15万円 | 52万円 | ||
| 炎症可視化マウス (IDOLマウス) |
C57BL/6N(黒毛) | ※ 本系統は繁殖効率が悪いため、凍結胚購入の場合の個数についてはご相談ください | 46万円 | |
| C57BL/6N(albino)(白毛) | ※ 本系統は繁殖効率が悪いため、凍結胚購入の場合の個数についてはご相談ください | 90万円 | ||
| 肥満抑制モデルマウス (Rmi1トラップマウス) |
C57BL/6N | 10万円 | 34万円 | |
| アトピー性皮膚炎モデルマウス (IL33 Tgマウス) |
C57BL/6J | 10万円 | 34万円 | |
| 赤色蛍光タンパク質発現マウス | C57BL/6N | 10万円 | 34万円 | |
| Ttr遺伝子エクソンヒト化マウス | C57BL/6N | 10万円 | 34万円 | |
| Ttr遺伝子エクソンヒト化変異マウス | C57BL/6N | 10万円 | 34万円 | |
| Fgfr3点変異ノックインマウス | C57BL/6N | 10万円 | 34万円 | |
- ※ 本製品の使用は、ご購入者の自施設における研究目的に限られています。
- ※ 本製品、およびその派生物を第三者への譲渡・配布・再販することはできません。
- ※ 本製品のご購入の際には、別途、ライセンス確認同意書のご提出をお願いしております。
- ※ ご発注にあたってはライセンス確認同意書の必要事項をもれなくご記入の上、販売店にお渡しください。
- ※ 可視化マウスの非臨床試験については、お客様にて検出機器(IVIS Imaging Systemまたはそれに準じたもの)をご用意いただく必要がございます。
01
生体ストレス可視化マウス(UMAI-Lucマウス)
生体ストレス可視化マウス
生体ストレス可視化マウス(UMAI-Lucマウス)は、ルシフェラーゼをレポーターとしてATF4の翻訳誘導を可視化できるUMAI-Luc遺伝子をもつトランスジェニックマウスです。
生体ストレスとATF4
ストレスはヒトの様々な病態おいて重要な役割を担っていると考えられていますが、様々なストレスに対して生体は共通のシグナル経路を使用して、対応します。この反応はintegrated stress response (ISR) と呼ばれ、転写因子であるActivating transcription factor 4 (ATF4)がその下流のストレス応答遺伝子の発現制御において中心的役割を果たします。この経路に関与するストレスにはアミノ酸飢餓、ウイルス感染、小胞体ストレス、酸化ストレスといったものが含まれます。
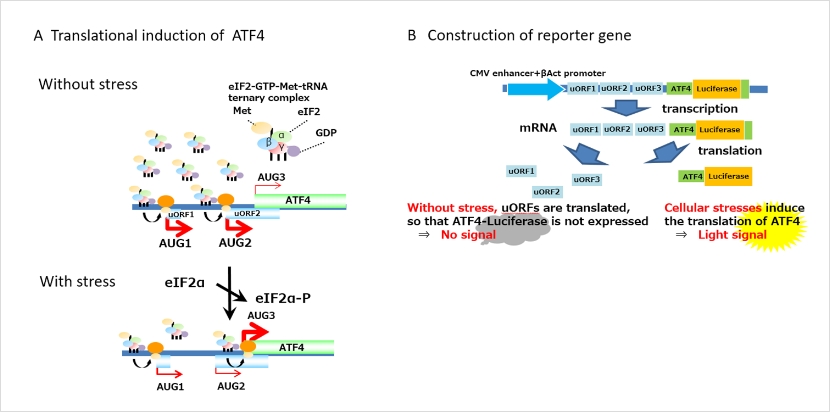
UMAI遺伝子
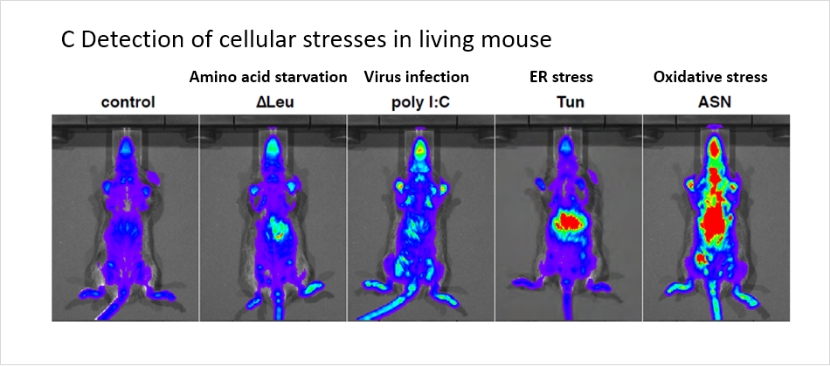
ATF4遺伝子から転写されるmRNAには、真のATF4翻訳域の上流に“偽”の翻訳域が存在します(上図A,B、uORF1, 2)。翻訳開始複合体eIF2-GTP-Met-tRNAにより、非ストレス時にはこの偽の翻訳域から翻訳が開始され(AUG1, AUG2)、ATF4タンパク質は産生されません(上図A非ストレス時)。しかし生体ストレスによって活性化されたリン酸化酵素によりeIF2αがリン酸化されると、翻訳開始反応が遅れ、真のATF4のタンパク質合成(AUG3)が開始されます(上図A非ストレス時)。UMAIはこの機構を用いてレポーター遺伝子を発現させる仕組みです(上図B)。UMAI-Lucマウスでは、アミノ酸飢餓(ΔLeu給餌)、疑似ウイルス感染(poly I:C投与)、小胞体ストレス (Tunicamycin投与)、酸化ストレス(亜ヒ酸投与)の各種ストレスを誘導した際に、発光シグナルの誘導が観察されました(下図C)。
生体におけるこれらストレスの継時的観察を行うツールとして、本マウスが有用であると考えられます。
参考文献
02
小胞体ストレス可視化マウス(ERAI-Lucマウス)
小胞体ストレス可視化マウス
小胞体ストレス可視化マウス(Tg型ERAI-Lucマウス、KI型ERAI-Lucマウス)では、ルシフェラーゼをレポーターとして小胞外ストレスを持つ細胞を発光で可視化するERAI遺伝子をもっています。
小胞体ストレスとは
小胞体ストレスは、細胞内におけるタンパク質の産生を担う小胞体において、タンパク質合成過程に生じた変性タンパク質が蓄積することにより引き起こされるストレスです。過度の小胞体ストレスは細胞死を誘発し、神経変性疾患や、メタボリックシンドロームなどの要因になると考えられています。また、老化現象、心筋梗塞、脳梗塞などの虚血性疾患や様々なウイルス感染症などにおいても、疾患と小胞体ストレスの関連が注目されています。
ERAI遺伝子
ERAI(ER stress activated indicator)には、小胞体ストレス因子であるXBP1タンパク質の発現制御の仕組みが利用されています(下図A)。小胞体ストレスがない状態では、XBP1タンパク質は合成後速やかに分解されます。一方、小胞体ストレスが生じると、XBP1 mRNAのイントロンが除かれ、活性型XBP1タンパク質が合成されます。ERAI遺伝子では、XBP1タンパク質とイントロンまでを含むcDNAをルシフェラーゼ配列の上流につないであります(下図B)。その結果、小胞体ストレス(Tunicamycin投与)のシグナルを受けてイントロン部分が除かれた場合にのみ、ルシフェラーゼタンパク質が翻訳されて、発光が見られる仕組みとなっています(下図C)。
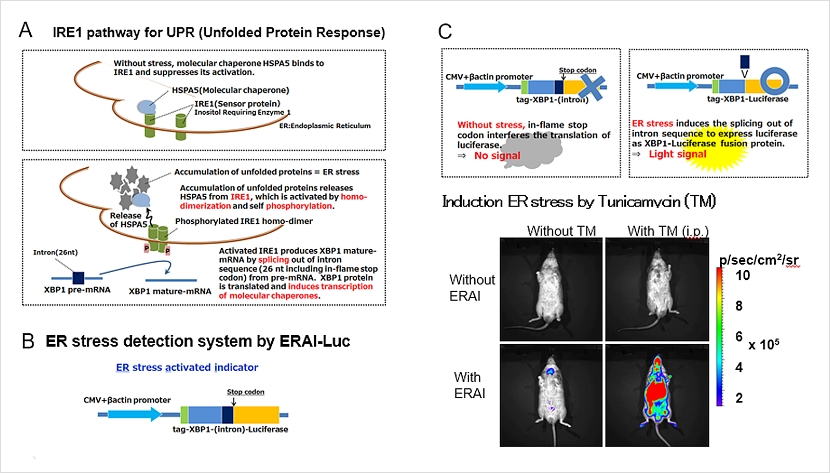
TG型ERAI-Lucマウス
CAGプロモーターでERAIが発現し、全身での小胞体ストレスの検出が可能です。
KI型ERAI-Lucマウス
Rosa26遺伝子座にloxPで挟まれたストップ配列と共にERAIをノックインしました。任意のCreマウスとの交配により、特定の組織でのERAIの発現が可能です。目的外の組織でのルシフェラーゼの発現を抑え、観察を容易にします。
参考文献
-
A transgenic mouse model for monitoring endoplasmic reticulum stress.
Nat. Med. 10, 98-102(2004)
特許
特許第4446057号 「生体刺激存在下でのmRNAのフレームシフトを利用した蛋白質の発現方法」
03
酸化ストレス可視化マウス(OKD-Lucマウス)
酸化ストレス可視化マウス
酸化ストレス可視化マウス(Tg型OKD-Lucマウス)では、ルシフェラーゼをレポーターとして酸化ストレスをもつ細胞を発光により可視化するOKD48遺伝子が利用されています。
酸化ストレスとは
酸化ストレスは、活性酸素などフリーラジカルの蓄積により、細胞内の酸化反応が亢進する状況です。これにより、DNA、脂質やタンパク質などの生体成分の酸化変性、細胞機能の障害が引き起こされます。さらに、これらの変性した生体成分が動脈硬化、糖尿病、リウマチなどの疾患の要因になると考えられます。
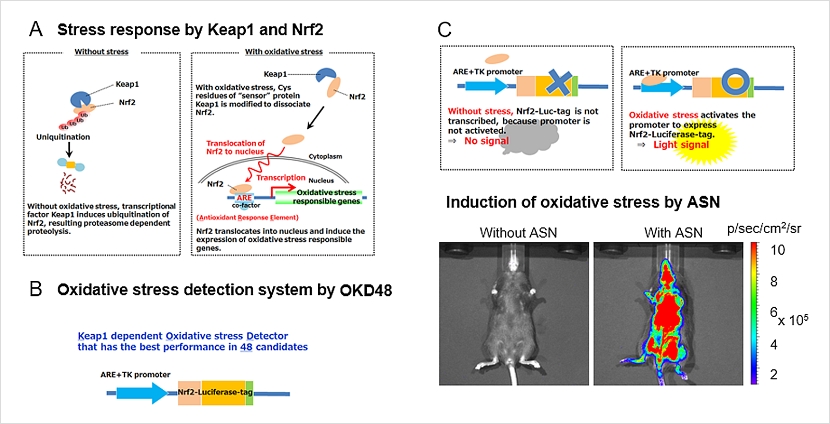
OKD48遺伝子
OKD48 (Keap1 dependent oxidative stress detector that has the best performance in 48 candidates)遺伝子には、酸化ストレス因子であるNrf2タンパク質の発現制御の仕組みが利用されています(下図A)。Nrf2タンパク質は酸化ストレス下で安定化、核移行します。さらに、核内でARE (antioxidant response element) を介し、酸化ストレス応答遺伝子を発現させます。酸化ストレスがない状態では、Nrf2タンパク質は合成後にKeap1によるユビキチン化を受け、速やかに分解されます。OKD48遺伝子はNrf2タンパク質のユビキチン化ドメインをルシフェラーゼと融合させて作られており、さらにAREの制御下で発現が制御されているので、酸化ストレス存在下でルシフェラーゼタンパク質を安定的に産生します(下図B,C)。
参考文献
-
A transgenic mouse model for monitoring oxidative stress.
Sci. Rep. 2, 229(2012).
特許
WO/2012/099279「酸化ストレスインジケーター発現用核酸構築物とその使用」
04
炎症可視化マウス(IDOLマウス)
炎症可視化マウス
炎症可視化マウス(Tg型IDOLマウス)では、ルシフェラーゼをレポーターとして炎症を発光により可視化するIDOL遺伝子が利用されています。
炎症とは
炎症は、創傷、微生物感染、自己免疫疾患などが原因として起こり、発赤、腫脹、発熱といった急性炎症の症状を呈します。慢性化した炎症は、老化、がん、動脈硬化、肥満、神経疾患など様々な病態と関わっていることが示唆されています。炎症箇所には、様々な炎症性細胞が浸潤し、炎症性因子を発現することが知られており、その代表的な因子としてIL-1β(interleukin 1 beta)があげられます。
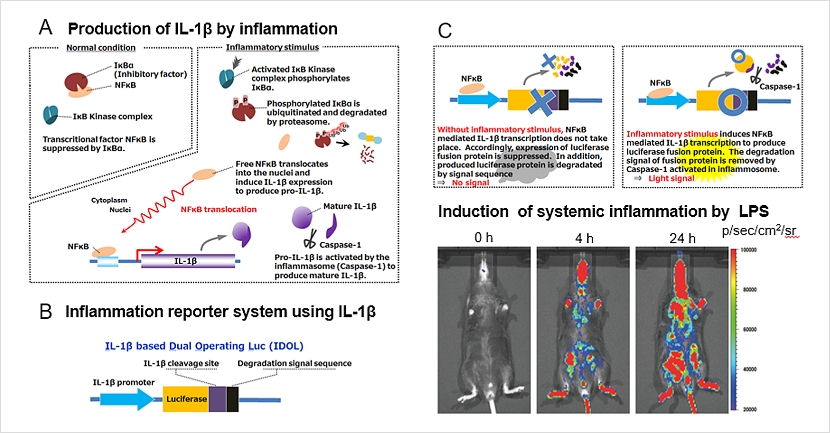
IDOL遺伝子
IDOL(IL-1β based Dual Operating Luciferase)遺伝子には、炎症性サイトカインであるIL-1βの発現制御システムが利用されています(下図A)。IL-1βはNFκBによる転写制御と、インフラマソームでのプロセッシングにより、その成熟型の発現が制御されています。NFκB は平常時にはIκBと結合して抑制された状態にありますが、炎症刺激によりIκBがリン酸化、分解されることによりNFκBが遊離して核内移行、IL-1βプロモーターに結合し、その転写を活性化します。IL-1βタンパク質は前駆体として産生され、炎症刺激により活性化されるCaspase 1を含むインフラマソームにより消化されて成熟型となります。
IDOL遺伝子では、IL-1βプロモーターの制御下のルシフェラーゼに、IL-1βのCaspase 1切断配列を介して、タンパク質分解を促進するPEST配列が融合してあります(下図B)。炎症刺激により、IDOL遺伝子の転写活性化が起こると同時に、合成されたタンパク質において分解促進配列が切断され、ルシフェラーゼが安定的に発現します(下図C)。
参考文献
-
Transgenic mouse model for imaging of interleukin- 1β-related inflammation in vivo.
Sci. Rep. 5, 17205,(2015).
特許
出願中
05
肥満抑制モデルマウス(Rmi1トラップマウス)
肥満抑制モデルマウス
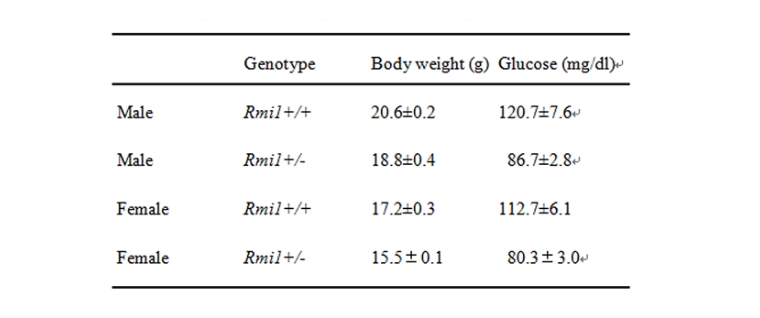
肥満抑制モデルマウスはTG Resource Bank®の中の1系統として、ジーントラップにより樹立されたものです。表現型を解析した結果、雌雄ともに有意な体重の減少と血糖値の低下が認められました。このマウスでは、通常食、高脂肪食を与えた時ともに野生型に比べて有意な体重増加の抑制が見られます。
参考文献
-
RMI1 deficiency in mice protects from diet and genetic-induced obesity.
FEBS J. 277, 677-686(2010).
06
アトピー性皮膚炎モデルマウス(IL33 Tgマウス)
アトピー性皮膚炎モデルマウス(IL33 Tgマウス)
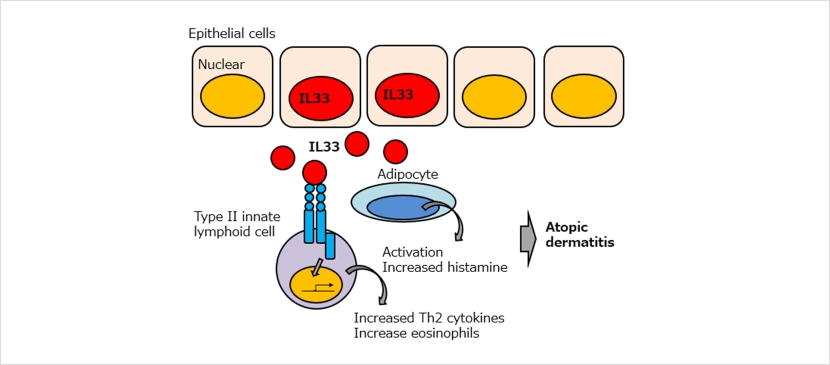
兵庫医科大学の今井康友先生、山西清文先生らは、IL33の皮膚における役割を調べるために、皮膚特異的なケラチン14プロモーター制御下でIL33遺伝子を発現させたトランスジェニックマウスを作製しました。その結果、このマウスは8週齢以降全てのマウスで、アトピー性皮膚炎を自然発症することが示されました。このマウスは、かゆみを持った皮膚炎が顔面、耳介、尾部等全身に生じ、表皮の肥厚と真皮内への炎症性細胞の浸潤、肥満細胞の増加、ケモカインの増加、高い値の血中IgGおよびヒスタミン濃度が見られます。これらのことから、皮膚で増加したIL33が肥満細胞、II型自然リンパ球の活性化を誘導し、その結果好酸球が増加することによりアトピー性皮膚炎が発症するというメカニズムが提唱されました。本マウスはヒトのアトピー性皮膚炎の症状を再現するモデルマウスとして、新規治療法開発に貢献することが期待されます。
BSRCグループでは、本マウスを使用した非臨床試験受託も承っております。リンクをご参照ください。
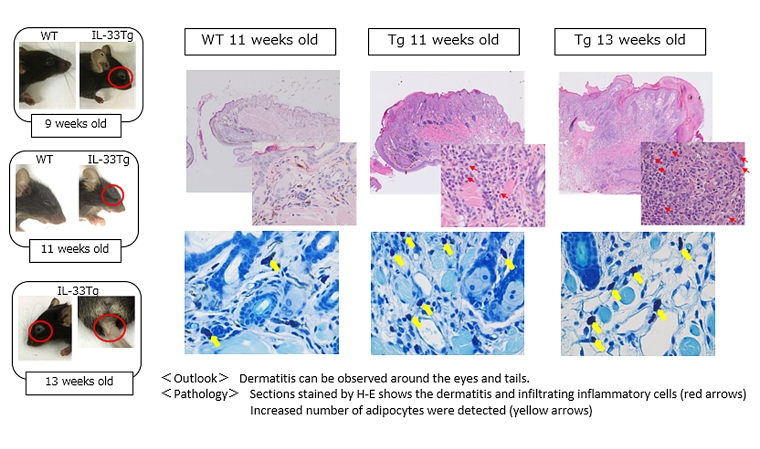
アトピー性皮膚炎とIL33
アトピー性皮膚炎は、アレルギー反応と関連する皮膚の炎症を伴う疾患で、慢性的に繰り返す皮膚炎と激しいかゆみを主症状とします。患者数は人口の約10~20%にも達するといわれており、社会問題ともなっています。アトピー性皮膚炎の原因としては、これまで様々な説が提唱されていますが、完全には解明されていません。
IL33は、様々な臓器の上皮細胞や血管内皮細胞の核内に局在し、細胞外へ放出されてリンパ球、肥満細胞、好塩基球、好酸球などの免疫系細胞を活性化するインターロイキンです。花粉症や喘息、鼻炎といったアレルギー疾患、関節炎、糖尿病、炎症性腸疾患など、免疫系が関与する様々な疾患に幅広く関与していると考えられています。アトピー性皮膚炎の皮膚においても、IL33は多く産生されていることが知られています。
参考文献
-
Proc. Natl. Acad. Sci. U.S.A. 110, 13921-13026(2013).
特許
PCT/JP2014/061931「アトピー性皮膚炎モデル動物及びその用途」
07
赤色蛍光タンパク質発現マウス
赤色蛍光タンパク質発現マウス
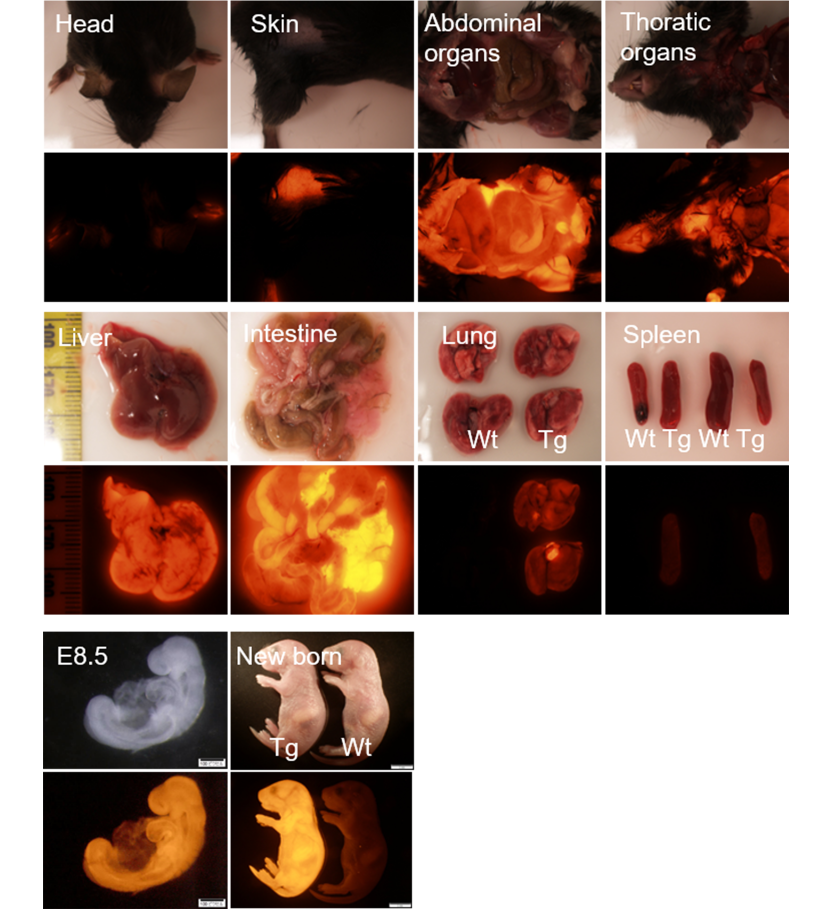
赤色蛍光を発するfresnoRFPを全身で発現するマウスです。蛍光ラベルされた細胞の単離に、また移植実験のドナーとして使用可能です。
IPフリーのfresnoRFPタンパク質を使用
蛍光タンパク質は様々な波長、強度のものが開発され、使用されていますが、多くのタンパク質ではその使用にライセンスが必要となっています。ATUM社(Newark, CA, USA、https://www.atum.bio/)では、Synthetic Biologyの手法を用いて多数の蛍光タンパク質をコードする遺伝子コレクションを確立し、これらの蛍光タンパク質については知的所有権の制限が設けられておりません。fresnoRFPはその中の赤色蛍光を発するタンパク質のひとつです。本マウスを使用するに当たりまして、購入者が蛍光タンパク質の使用についてライセンスを取得する必要はございません。
fresnoRFPは以下の蛍光特性をもちます。
- Ex..max: 553 nm
- Em. max: 592 nm
CAG promoterによる全身での発現
本マウスはfresnoRFPを全身的に発現させるため、CAG promoterを用い、受精卵インジェクションにより当社で作製したトランスジェニックマウスです。図に示すように、各臓器、また胚において蛍光の発現を見ることができます。
08
変異ルシフェラーゼ発現マウス、変異EGFP発現マウス
変異ルシフェラーゼ発現マウス、変異EGFP発現マウス
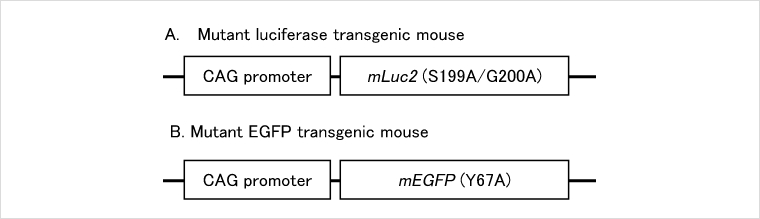
活性をもたない変異ルシフェラーゼ、蛍光をもたないEGFPを発現するトランスジェニックマウス系統です。ルシフェラーゼまたはEGFPを発現して光る同種移植細胞に対して免疫寛容を示し、高い効率での移植細胞の増殖が見られます。
同所性移植モデルは、がん細胞の浸潤や転移の研究に用いられています。その中でも同種移植モデルは、免疫不全マウスへの移植とは異なり、宿主マウスの免疫系が正常に保たれているため、移植細胞への宿主免疫系細胞の関与を調べるために有用なものとなります。
一方、生物発光や蛍光を用いた生体イメージングは、がん転移や移植組織、細胞の状態を調べるために有用な方法で、ルシフェラーゼやEGFPがレポーター遺伝子としてよく使用されます。
しかしながら、ルシフェラーゼやEGFPを発現した同種細胞を移植すると、これらのレポータータンパク質に対する免疫反応が惹起され、移植細胞の増殖が抑制されることがわかりました。この問題を解決するために、京都大学の武藤誠先生のグループでは、点変異を導入することにより、酵素活性をもたないルシフェラーゼおよび蛍光を発しないEGFPを開発し、これらの変異タンパク質を発現するトランスジェニックマウスをそれぞれ作製しました(下図A, B)。BALB/cバックグラウンドのこれらのトランスジェニックマウスに、ルシフェラーゼあるいはEGFPをレポーター遺伝子として導入したBALB/c系統由来のColon-26を移植すると、野生型マウスに移植した場合と比較して、少数の細胞からの腫瘍増殖が観察されました(下図C, D)。
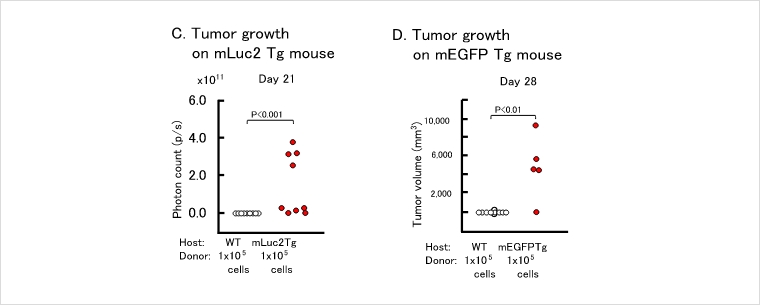
本マウス系統はC57BL/6J系統で維持しておりますが、他系統とのF1が使用可能です。F1マウスを増産してからの提供も可能です。
参考文献
-
Genes to Cells 23, 580-589(2018).
09
Ttr遺伝子エクソンヒト化マウス
Ttr遺伝子エクソンヒト化マウス
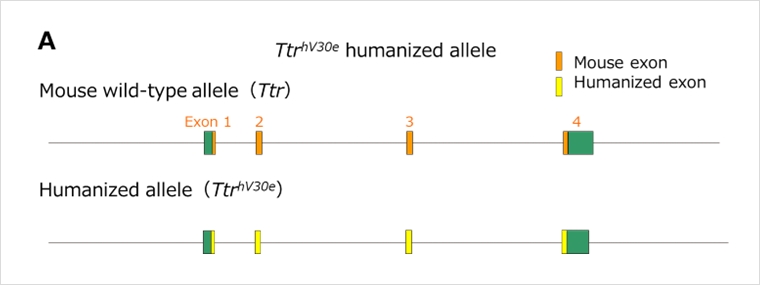
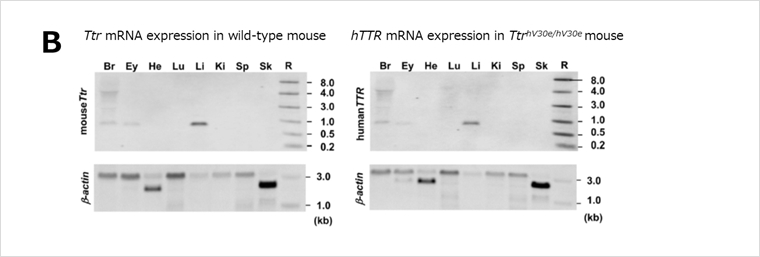
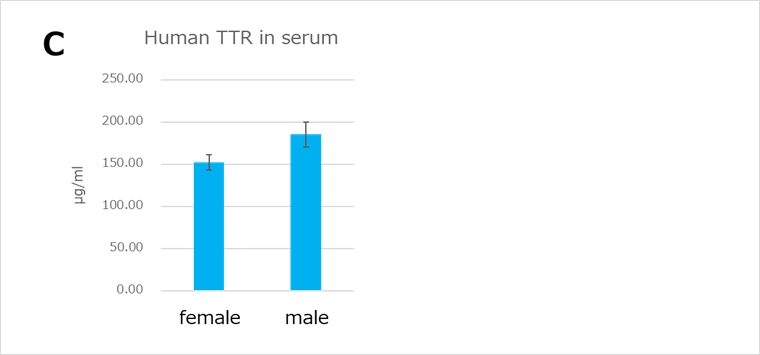
家族性アミロイドポリニューロパチー(FAP:familial amyloid polyneuropathy)の原因遺伝子であることが知られるTTR遺伝子について、マウスTtr遺伝子のエクソンのコーディング配列のみをヒト配列に置換したエクソンヒト化マウスです(図A)。マウスTtr遺伝子の遺伝子発現制御領域がすべて残っているため、このマウスにおいては、マウスTtr遺伝子産物と同等の量及び組織特異性を持ったヒトTTR遺伝子が発現しています(図B・C)。ヒトTTR遺伝子産物を標的とした治療法の開発に有用です。
参考文献
-
TTR exon-humanized mouse optimal for verifying new therapies for FAP.
Biochem. Biophys. Res. Comm. 599, 69-74(2022).
特許
「エクソンヒト化マウス」は株式会社トランスジェニックにより特許申請中の作製技術です。
10
Ttr遺伝子エクソンヒト化変異マウス
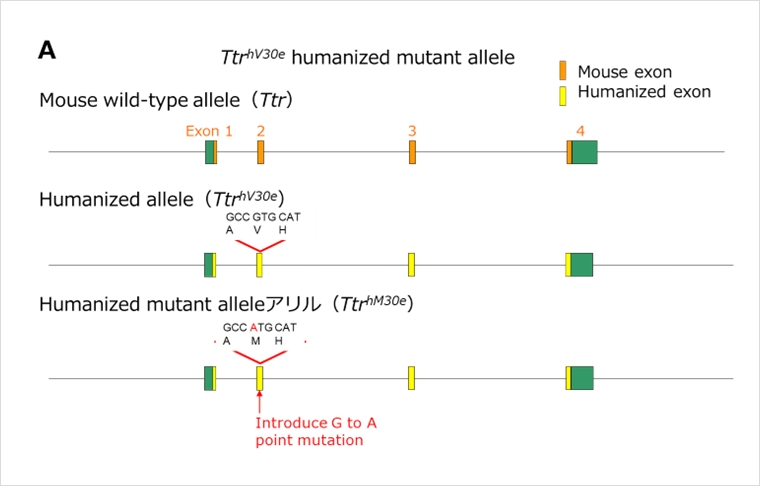
Ttr遺伝子エクソンヒト化変異マウス
上記Ttr遺伝子エクソンヒト化マウスに、ヒト家族性アミロイドポリニューロパチー(FAP)でみられる30番目のバリンがメチオニンとなる1アミノ酸置換変異を導入したTtr遺伝子エクソンヒト化変異マウスです(図A)。Ttr遺伝子エクソンヒト化マウスと合わせて、ヒトTTR遺伝子産物を標的とした治療法の開発に有用です。
特許
「エクソンヒト化マウス」は株式会社トランスジェニックにより特許申請中の作製技術です。
11
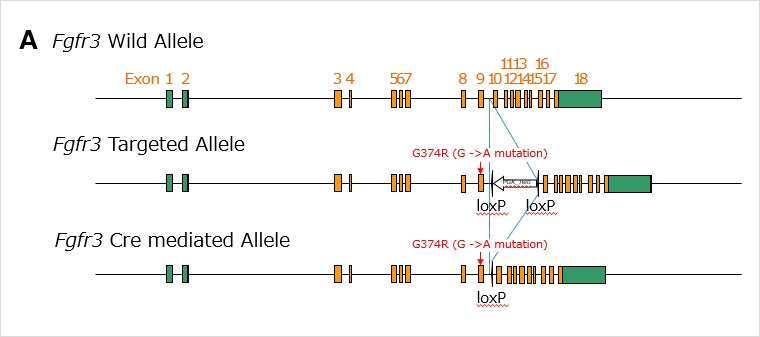
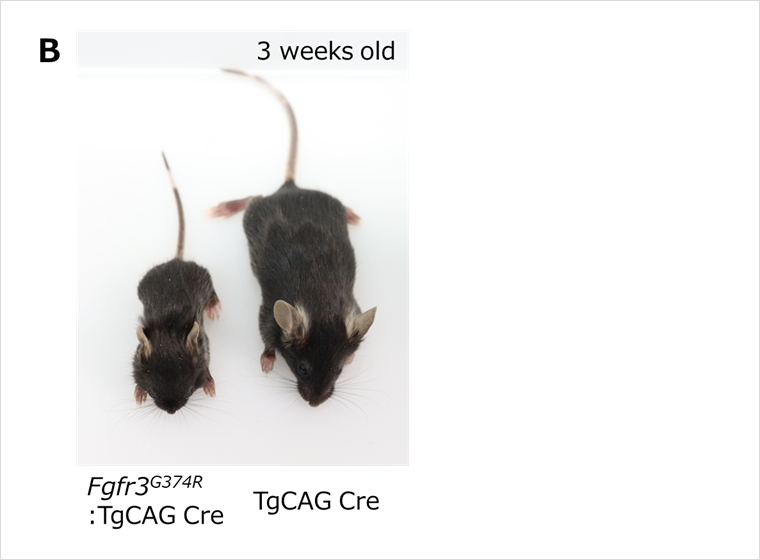
Fgfr3点変異ノックインマウス
Fgfr3点変異ノックインマウス
軟骨無形成症は遺伝子変異によって引き起こされる骨の成長障害で、主に幼少期から成長期にかけての骨の発育に影響があります。この疾患は、軟骨が正常に形成されないため、骨が短く、異常な形状、変形が見られます。疾患の原因遺伝子としては、Fgfr3遺伝子が知られています。Fgfr3 (fibroblast growth factor receptor 3) は、軟骨の成長や骨の発育に関与する成長因子の受容体をコードする遺伝子であり、この遺伝子に変異が生じることで、軟骨の成長が阻害されると考えられています。
本マウスではヒト患者でみられるFGFR3変異に相当するアミノ酸置換(G374R)を導入したマウスとなります(図A)。この変異は遺伝的に優性で、ヘテロ接合体で疾患が現れますが、本マウスで変異を導入したアリルはPGK promoterで制御されるネオマイシン耐性遺伝子が挿入されており、その影響で変異アリルからのタンパク質発現は抑制されており、これを持つアリルでは表現型が現れません。しかし、このマウスを全身あるいは生殖系列でCreを発現するマウスを交配することによりloxPではさまれたネオマイシン耐性遺伝子が除去されると、変異タンパク質が発現し、成長が阻害される表現型が現れます(図B)。