BSRCでは、大学や研究機関で樹立、解析された遺伝子改変マウスについてのライセンス許諾を受けて、非臨床試験受託を提供いたします。
非臨床試験受託
ラインアップ
当社では、これらのモデル以外に、オーストリアQPS社における神経変性疾患の遺伝子改変病態モデル動物を用いた非臨床試験受託を日本代理店として提供いたします。リンクページをご覧ください。
アルツハイマー病
APPosk-Tgマウス(Mouse prion promoter – Human APP E693Δ)
精神・神経疾患(うつ病様)
ProBDNF KIマウス(proBDNF R125M/R127L knock-in)
認知症
SJLBマウス(Mouse prion promoter – Human TAU N279K)
アトピー性皮膚炎
IL33 Tgマウス(K14 promoter – Mouse IL33)
| 疾患・病態 | 遺伝子改変モデルマウス |
|---|---|
| アルツハイマー病 | APPosk-Tgマウス(Mouse prion promoter – Human APP E693Δ) |
| 精神・神経疾患(うつ病様) | ProBDNF KIマウス(proBDNF R125M/R127L knock-in) |
| 認知症 | SJLBマウス(Mouse prion promoter – Human TAU N279K) |
| アトピー性皮膚炎 | IL33 Tgマウス(K14 promoter – Mouse IL33) |
- ※ 価格は試験内容によります。ご相談ください。
01
アルツハイマーモデル
APPosk-Tgマウス
ヒトAPPosk変異タンパク質を脳内で発現するトランスジェニックマウスがAPPosk-Tgマウスです。APPosk-Tgマウスでは、加齢に伴って脳内にAβオリゴマーの蓄積が検出されますが、24ヵ月齢においても老人斑は見られません。しかし、このマウスでは、シナプス消失、タウの異常リン酸化、グリア細胞の活性化、神経細胞死といった多くのアルツハイマー病の病理が見られます。このことから、APPosk-TgマウスはAβオリゴマーがアルツハイマー病理を引き起こすオリゴマー仮説を支持するモデルとなりました。さらにこのモデルマウスは、Aβオリゴマーによるアルツハイマー発症の病態をターゲットとする治療法、創薬の研究に用いることが可能です。
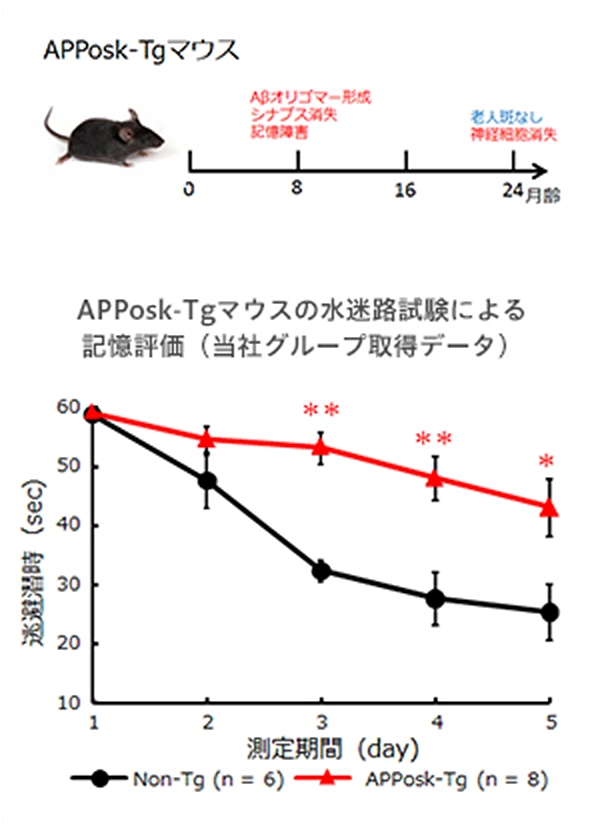
平均値±標準誤差を表す。
*p<0.05,** p<0.01 t-test
アルツハイマー病とアミロイド仮説
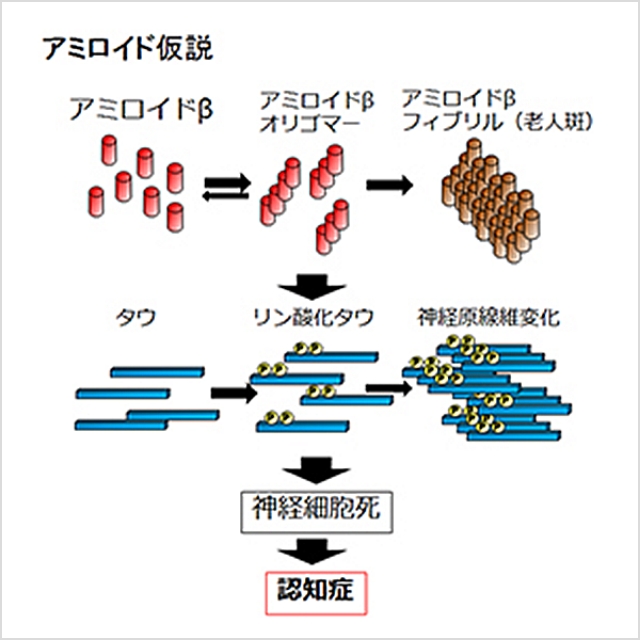
アルツハイマー病は認知機能低下を主な症状とする進行性の神経変性疾患で、その特徴的な脳内病理変化としてアミロイドβ(Aβ)の不溶性凝集体の蓄積である老人斑の形成、タウタンパク質の不溶性凝集体の蓄積である神経原線維変化(neurofibrillary tangle, NFT)の形成、脳萎縮が知られています。 アルツハイマー病の発症機序を説明するものとして、次のようなアミロイド仮説が知られています。
- Aβが自己凝集によって可溶性凝集体(Aβオリゴマー)や不溶性凝集体(Aβフィブリル)を形成する。
- Aβ凝集体がタウタンパク質の過剰なリン酸化と自己凝集を誘導し、異常な凝集タウであるNFTを形成する。
- NFTが神経細胞死を誘導する。
- 脳萎縮が進行、認知障害が生じ、アルツハイマー病を呈する。
オリゴマー仮説とOsaka変異
初期のアミロイド仮説においては老人斑中の不溶性凝集体であるAβフィブリルによる神経細胞死によって認知機能低下が引き起こされていると考えられていました。その後、細胞死誘導に必要なAβ濃度が生体内の条件に比べて高すぎること、アルツハイマー病患者の疾患重篤度と脳内のAβフィブリルの量と相関していないことから、Aβフィブリル以外のものが毒性を持っている可能性が示唆されました。
これらのことから、生理的な濃度でシナプス機能の障害を引き起こすAβオリゴマーが病態の発症に重要であるとする「オリゴマー仮説」が提唱されました。しかし、アルツハイマー病患者の脳内には、Aβオリゴマーと同時にAβフィブリルも存在することから、どちらがアルツハイマー病発症に寄与しているのかを検証することは難しい問題でした。
大阪市立大学の富山貴美先生、森啓先生らのグループは、2008年に家族性アルツハイマー病の新しい遺伝子変異を報告しました。Osaka変異と名付けられたこの遺伝子変異は、アミロイド前駆体タンパク質(amyloid precursor protein, APP) における1アミノ酸の欠失型変異です(APPosk, E693Δ)。APPoskから産生されるAβは1アミノ酸を欠失した変異型Aβ(E22Δ) となり、Aβフィブリルを形成せず、Aβオリゴマーを非常に多く形成するという特徴を有していました。Osaka変異を持つアルツハイマー病患者の脳には老人斑が検出されず、この発見によってAβオリゴマーのみでアルツハイマー病が発症することが初めて証明されました。
参考文献
-
A new amyloid β variant favoring oligomerization in Alzheimer’s-type dementia.
Ann. Neurol. 63, 377-387(2008).
-
J. Neurosci. 30, 4845-4856(2010).
-
Rifampicin is a candidate preventive medicine against amyloid β and tau oligomers.
Brain 139, 1568-1586(2016).
特許
特許第4776544号「変異型アミロイドタンパク質」
02
精神・神経疾患モデル
proBDNF KIマウス
産業技術総合研究所の小島正己先生らは、proBDNFからmatureBDNFへのプロセッシング障害が、精神・神経疾患に関与するのではないかと考え、このプロセッシングを抑制する変異を導入したノックインマウスを作製しました。
このマウスは尾懸垂試験および強制遊泳試験において無動化時間が長期化するうつ病様の表現型を示します。うつ病をはじめとする精神・神経疾患のご研究に、本マウスを用いた行動試験をお役立てください。
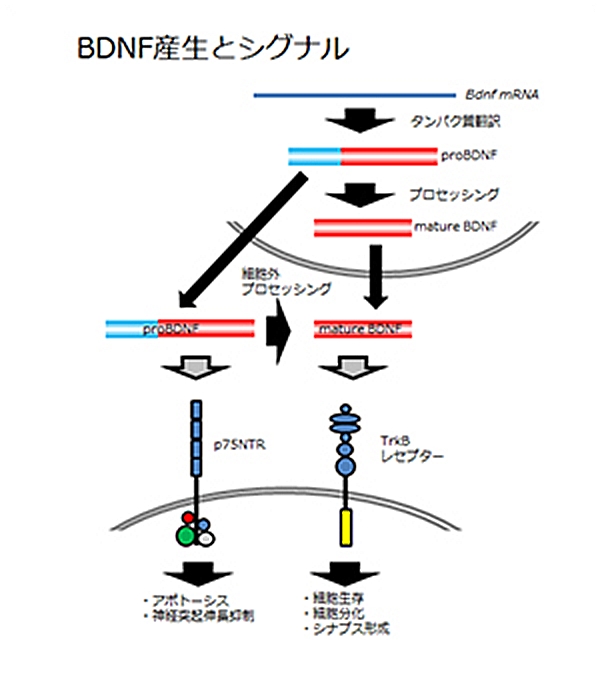
BDNFと精神・神経疾患
神経栄養因子の一つである脳由来神経栄養因子 (brain-derived neurotrophic factor) は、うつ病をはじめとした様々な精神・神経疾患に関与するものとして近年注目されています。BDNFは脳内における神経回路網の形成や発達、さらにその生存に重要であること、また、シナプスの可塑性にも関与し記憶や学習の形成において重要な役割を果たしていることが示されてきています。BDNFは前駆体であるproBDNFからプロテアーゼによって切断され、成熟型のBDNF (matureBDNF) が生成されます。matureBDNFはチロシンキナーゼ受容体TrkBに結合し、細胞生存、細胞分化、シナプス形成などを誘導しますが、proBDNFは別の受容体であるp75NTRに結合し、アポトーシス、神経突起伸長抑制などをもたらします。

参考文献
-
Int. J. Mol. Sci. 21, 3984(2020).
-
Phamacol. Res. 105, 93-98(2016 review).
-
Pro. Nat. Aca. Sci. 112, E3067-3074(2015).
-
Neurosci. Letters 473, 229-232(2010).
特許
特許第5414012号「変異BDNF遺伝子導入ノックインマウス」
03
認知症モデル
SJLBマウス
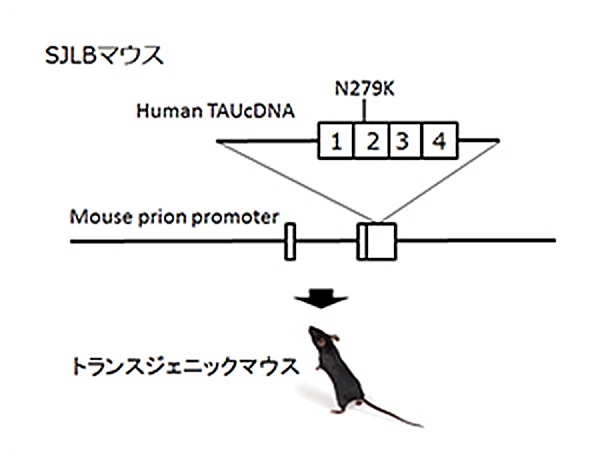
FTDP-17においてタウタンパク質における遺伝子変異は複数報告されていますが、その一つがpoint mutationでアミノ酸置換が起こるN279K変異です。このN279K変異マウスを持つタウタンパク質をマウスの脳内で発現させたのがSJLBマウスです。このマウスでは空間学習、恐怖の学習能力が低下しており、認知障害のモデル動物として、タウをターゲットとした認知症の治療法、創薬の研究に役立つものと考えられます。コントロールとして、ヒト野生型TAUのトランスジェニックUBJAPマウスを用意しています。
タウタンパク質と認知症
認知症にはアルツハイマー病以外にも様々なものが知られていますが、そのうち「第17染色体遺伝子に連鎖しパーキンソニズムを伴う家族性前頭側頭葉認知症 (Frontotemporal dementia and parkinsonism linked to chromosome 17, FTDP-17)」は常染色体優性で遺伝することが知られる疾患です。FTDP-17は運動障害並びに認知機能障害が通常40~60歳で発症し、一定年数の間で深刻な認知症に進展することが知られています。FTDP-17はタウタンパク質の異常によるものであることが知られています。タウタンパク質の異常蓄積は神経死に直接関連していると考えられており、アルツハイマー病の原因とも考えられています。FTDP-17においてタウタンパク質における遺伝子変異は複数報告されていますが、その一つがpoint mutationでアミノ酸置換が起こるN279K変異です。
参考文献
-
FEBS letters 579, 5704-5712(2005).
特許
JP2011043428A「非ヒトモデル動物を用いたパーキンソン症候群の検査方法」
04
アトピー性皮膚炎モデル
IL33 Tgマウス
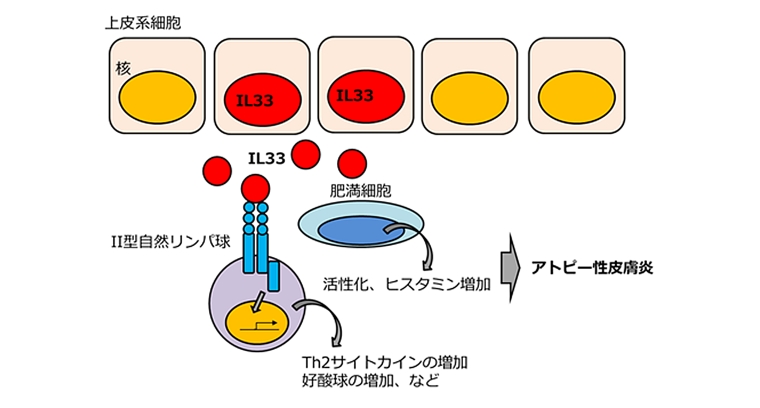
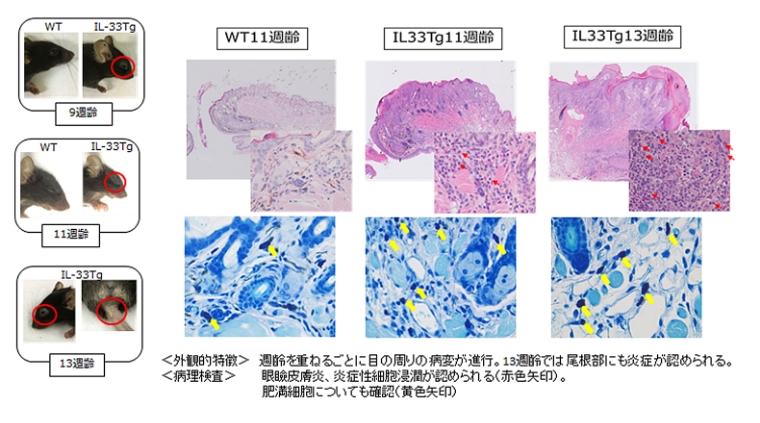
兵庫医科大学の今井康友先生、山西清文先生らは、IL33の皮膚における役割を調べるために、皮膚特異的なケラチン14プロモータ制御下でIL33遺伝子を発現させたトランスジェニックマウスを作製しました。その結果、このマウスは8週齢以降全てのマウスで、アトピー性皮膚炎を自然発症することが示されました。このマウスは、かゆみを持った皮膚炎が顔面、耳介、尾部等全身に生じ、表皮の肥厚と真皮内への炎症性細胞の浸潤、肥満細胞の増加、ケモカインの増加、高い値の血中IgGおよびヒスタミン濃度が見られます。これらのことから、皮膚で増加したIL33が肥満細胞、II型自然リンパ球の活性化を誘導し、その結果好酸球が増加することによりアトピー性皮膚炎が発症するというメカニズムが提唱されました。
本マウスはヒトのアトピー性皮膚炎の症状を再現するモデルマウスとして、新規治療法開発に貢献することが期待されます。
BSRCグループでは本アトピー性皮膚炎モデルを用い、病理組織学的検査、血液生化学検査、各種ELISA測定、免疫染色、遺伝子解析など、様々な解析を含む非臨床試験受託を提供いたします。
アトピー性皮膚炎とIL33
アトピー性皮膚炎は、アレルギー反応と関連する皮膚の炎症を伴う疾患で、慢性的に繰り返す皮膚炎と激しいかゆみを主症状とします。患者数は人口の約10~20%にも達するといわれており、社会問題ともなっています。アトピー性皮膚炎の原因としては、これまで様々な説が提唱されていますが、完全には解明されていません。
IL33は、様々な臓器の上皮細胞や血管内皮細胞の核内に局在し、細胞外へ放出されてリンパ球、肥満細胞、好塩基球、好酸球などの免疫系細胞を活性化するインターロイキンです。花粉症や喘息、鼻炎といったアレルギー疾患、関節炎、糖尿病、炎症性腸疾患など、免疫系が関与する様々な疾患に幅広く関与していると考えられています。アトピー性皮膚炎の皮膚においても、IL33は多く産生されていることが知られています。
参考文献
-
Proc. Natl. Acad. Sci. U.S.A. 110, 13921-13026(2013).
PCT/JP2014/061931「アトピー性皮膚炎モデル動物及びその用途」

